Vaksin influenza

| |
|---|---|
| Seorang anggota Angkatan Laut AS sedang divaksinasi dengan vaksin influenza | |
| Data klinis | |
| Nama dagang | Fluarix, Fluzone, other |
| AHFS/Drugs.com | monograph |
| Kat. kehamilan | C(US) |
| Status hukum | ℞-only (US) |
| Rute | IM, intranasal, intradermal |
| Pengenal | |
| Kode ATC | J07BB01 |
| ChemSpider | none |
| Data kimia | |
| Rumus | ? |
Vaksin influenza, juga dikenal sebagai suntikan flu, adalah vaksin yang melindungi manusia dari influenza.[1] Vaksin dikembangkan dua kali setahun karena virus influenza cepat berubah.[1] Sementara keefektifannya bervariasi dari tahun ke tahun, sebagian besar memberikan perlindungan yang tinggi terhadap influenza.[1][2] Mereka mengurangi jumlah hari kerja yang terlewat setengah hari.Vaksinasi anak-anak dapat melindungi orang-orang di sekitar mereka.[1] Efektivitas pada mereka yang berusia di bawah 2 tahun dan berusia di atas 65 tahun adalah berusia di atas 5 tahun.[3][4][5]
Organisasi Kesehatan Dunia (WHO) dan Pusat Pengendalian dan Pencegahan Penyakit AS (CDC) merekomendasikan vaksinasi tahunan untuk hampir semua orang berusia di atas enam bulan, terutama yang berisiko tinggi.[1][6] Pusat Pengendalian dan Pencegahan Penyakit Eropa juga merekomendasikan vaksinasi tahunan kelompok berisiko tinggi.[7] Kelompok-kelompok ini mencakup ibu hamil, orang tua, anak-anak berusia antara enam bulan dan lima tahun, mereka yang memiliki masalah kesehatan lainnya, dan juga mereka yang bekerja di bidang kesehatan.[1]
Vaksin umumnya aman. Demam terjadi pada lima sampai sepuluh persen anak-anak yang divaksinasi, dan merasa lelah atau sakit otot dapatjuga terjadi. Pada tahun-tahun tertentu, vaksin menyebabkan sindrom Guillain-Barré pada orang tua dengan kisaran sekitar satu kasus per juta dosis. Seharusnya vaksin tidak diberikan kepada orang-orang dengan alergi parah terhadap telur atau versi vaksin sebelumnya. Vaksin datang dalam bentuk virus yang tidak aktif dan lemah. Versi tidak aktif harus digunakan bagi mereka yang sedang hamil. Vaksin masuk dalam bentuk yang disuntikkan ke otot, disemprotkan ke hidung, atau disuntikkan ke lapisan tengah kulit.[1] <! - Sejarah, masyarakat, dan budaya -> Vaksinasi terhadap influenza Pada tahun 1930an dengan persediaan berskala besar di Amerika Serikat dimulai pada tahun 1945.[8][9] Ada dalam World Health Organization's List of Essential Medicines, obat-obatan yang paling efektif dan aman yang dibutuhkan dalam sistem kesehatan.[10] Harga grosir di seluruh dunia berkembang sekitar $ 5,25 USD per dosis pada tahun 2014.[11] Di Amerika Serikat, harganya kurang dari $ 25 USD.[12]
Penggunaan medis[sunting | sunting sumber]
Pusat Pengendalian dan Pencegahan Penyakit, merekomendasikan vaksin flu untuk melindungi orang dari flu dan mencegah penyebarannya. Vaksin flu juga dapat mengurangi keparahan flu jika seseorang mengontrak strain flu yang tidak mengandung.[13] Setelah vaksinasi dibutuhkan waktu dua minggu untuk membentuk antibodi.[14]
Sebuah meta-analisis tahun 2012 menemukan bahwa vaksinasi flu yang efektif 67 persen; Populasi yang paling diuntungkan adalah orang dewasa HIV-positif berusia 18 tahun sampai 55 tahun (76 persen), orang dewasa sehat berusia 18 tahun sampai 46 tahun (sekitar 70 persen), dan anak-anak sehat berusia 6 bulan sampai 24 bulan (66 persen).[15]
Efektivitas[sunting | sunting sumber]
Vaksin dinilai dari khasiatnya; Sejauh mana dapat mengurangi risiko penyakit dalam kondisi terkendali, dan keefektifannya, pengurangan risiko diamati setelah vaksin mulai digunakan.[16] Dalam kasus influenza, efektivitas diharapkan lebih rendah daripada khasiatnya karena diukur menggunakan tingkat penyakit seperti influenza, yang tidak selalu disebabkan oleh influenza.[17] Vaksin influenza umumnya menunjukkan khasiat yang tinggi, yang diukur dengan produksi antibodi pada model hewan atau orang yang divaksinasi. .[18] Namun, studi tentang efektivitas vaksin flu di dunia nyata itu lebih sulit; Vaksin mungkin tidak sempurna, prevalensi virus sangat bervariasi setiap tahun, dan influenza sering bingung dengan adanya penyakit mirip influenza.[19] Namun, dalam beberapa tahun (16 dari 19 tahun sebelum 2007), strain vaksin flu telah sesuai dengan strain yang beredar,[20] bahkan vaksin yang tidak serasi sering kali dapat memberikan perlindungan silang.[14]
Uji coba vaksin influenza aktif dan tidak aktif terhadap influenza musiman telah dirangkum dalam beberapa meta-analisis tahun 2012. Studi tentang vaksin hidup memiliki data yang sangat terbatas, tetapi persiapan ini kemungkinan lebih efektif daripada vaksin yang tidak aktif.[21] Meta-analisis memeriksa efikasi dan efektivitas vaksin yang tidak aktif terhadap influenza musiman pada orang dewasa,[17] anak-anak,[5] dan orang tua. .[22][23]
Anak-anak[sunting | sunting sumber]
CDC merekomendasikan agar semua orang kecuali bayi di bawah usia 6 bulan harus menerima vaksin influenza musiman.[6] Kampanye vaksinasi biasanya memusatkan perhatian kepada orang-orang yang berisiko tinggi mengalami komplikasi serius jika mereka terkena flu, seperti ibu hamil, anak-anak di atas enam bulan, orang tua, orang-orang dengan penyakit kronis atau orang-orang dengan sistem kekebalan tubuh yang lemah, dan juga orang-orang yang mereka hadapi, seperti petugas layanan kesehatan.[6][24]
Karena tingkat kematian tinggi di antara bayi yang terkena influenza, penghuni rumah dan perawat bayi harus divaksinasi untuk mengurangi risiko terkena infeksi influenza pada bayi.[24]
Pada anak-anak, vaksin kembali menunjukkan kemanjuran yang tinggi, tetapi efektivitasnya rendah untuk mencegah "penyakit seperti flu".[5] Pada anak-anak di bawah usia dua tahun, datanya sangat terbatas, tetapi vaksinasi tidak memberi manfaat yang signifikan.[5]
Orang dewasa[sunting | sunting sumber]
Pada orang dewasa yang tidak divaksinasi, 16% mendapatkan gejala yang mirip dengan flu, sementara hanya sekitar 10% orang dewasa yang divaksinasi.[17] Vaksinasi menurunkan kasus influenza yang dikonfirmasi dari sekitar 2,4% menjadi 1,1%.[17] Tidak ada efek rawat inap yang ditemukan.[17]
Pada pekerja, review oleh Cochrane Collaboration menemukan bahwa vaksinasi menghasilkan sedikit penurunan pada gejala influenza dan hari kerja yang hilang, tanpa mempengaruhi komplikasi terkait transmisi dan influenza.[17] Pada pekerja yang sehat, vaksin influenza dapat memberikan perlindungan moderat terhadap influenza yang dikonfirmasi secara virologi, meskipun perlindungan semacam itu berkurang atau tidak berfungsi di beberapa musim.[3]
Para pekerja layanan kesehatan, menemukan keuntungan bersih berdasarka tinjauan pada tahun 2006.[25] Dari delapan belas studi dalam tinjauan ini, hanya dua yang menilai hubungan mortalitas pasien dibandingkan dengan penggunaan serapan vaksin influenza; Keduanya menemukan tingkat vaksinasi perawatan kesehatan yang lebih tinggi berkorelasi dengan kematian pasien yang berkurang.[25] Tinjauan tahun 2014 menemukan manfaat bagi pasien ketika petugas layanan kesehatan divaksinasi, karena didukung oleh bukti moderat [26] yang sebagian didasarkan pada pengurangan yang diamati pada penyebab kematian pada pasien yang petugas layanan kesehatannya divaksinasi dibandingkan dengan pasien di mana Petugas layanan kesehatan tidak diberi vaksin.[27]
Lansia[sunting | sunting sumber]
Bukti untuk efek pada orang dewasa berusia di atas 65 tahun tidak jelas/kurang bukti.[28] Tinjauan sistematis memeriksa kedua studi kontrol terkontrol dan kasus acak menemukan kurangnya bukti berkualitas tinggi.[3][22] Studi kasus kontrol menemukan efek terhadap influenza yang dikonfirmasi oleh laboratorium, pneumonia, dan kematian di antara lansia yang tinggal di masyarakat.[29][30]
Kelompok yang paling rentan terhadap flu non-pandemi, orang tua, paling tidak mendapatkan vaksin ini. Ada beberapa alasan di balik penurunan tajam dalam keampuhan vaksin ini, yang paling umum adalah fungsi kekebalan dan kekebalan menurun seiring dengan usia lanjut.[31] Pada tahun non-pandemi, seseorang di Amerika Serikat berusia 50-64 hampir sepuluh kali lebih mungkin meninggal karena kematian terkait influenza daripada orang yang lebih muda, dan seseorang yang berusia di atas 65 tahun lebih mungkin meninggal dunia. Kematian terkait influenza dari kelompok usia 50-64.[32]
Ada vaksin flu dosis tinggi baru yang diformulasikan secara khusus untuk memberikan respon kekebalan yang lebih kuat.[33] Bukti yang ada menunjukkan bahwa memvaksinasi orang tua dengan vaksin dosis tinggi menyebabkan respons kekebalan lebih kuat terhadap influenza dibandingkan dengan vaksin dosis reguler.[34]
Vaksinasi petugas layanan kesehatan yang bekerja dengan orang lanjut usia direkomendasikan di banyak negara, dengan tujuan mengurangi wabah influenza pada populasi rentan ini.[35][36][37] Meskipun tidak ada bukti konklusif dari uji klinis acak yang memvaksinasi petugas layanan kesehatan membantu melindungi orang tua dari influenza, ada bukti tentatif tentang manfaat.[38]
Kehamilan[sunting | sunting sumber]
Serta melindungi ibu dan anak dari dampak infeksi influenza, imunisasi ibu hamil cenderung meningkatkan peluang mereka mengalami kehamilan seumur hidup yang sukses.[39] Vaksin influenza inaktif yang trivalen sangat melindungi ibu hamil yang terinfeksi HIV.[40]
Keamanan[sunting | sunting sumber]
Sementara ini efek samping dari vaksin flu bisa terjadi, tetapi efeknya kecil. Vaksin flu juga dapat menyebabkan efek samping yang serius, termasuk reaksi alergi, tetapi ini jarang terjadi. Selain itu, efek samping dan risiko inokulasi yang umum tetapi ringan dan bila dibandingkan dengan risiko dan dampak kesehatan parah dari epidemi influenza yang didokumentasikan dengan baik, penyakit di rumah sakit, dan kematian.[41]
Vaksinasi flu dapat menyebabkan efek samping seperti pilek dan sakit tenggorokan, yang berlangsung selama beberapa hari. Alergi telur juga menjadi perhatian, karena vaksin flu umumnya dibuat dengan menggunakan telur;[42][43] Namun, penelitian tentang alergi telur dan vaksinasi influenza [44] telah menyebabkan beberapa kelompok penasihat merekomendasikan vaksin bagi mereka yang alergi ringan dan Dimonitor vaksinasi untuk orang-orang yang parah.[45] Sebuah penelitian besar terhadap hampir 800 anak-anak di Inggris dengan alergi telur, termasuk di atas 250 dengan reaksi anafilaksis sebelumnya, memiliki reaksi alergi sistemik bila diberi vaksin flu yang dilemahkan.[46][47] Pada tanggal 17 Januari 2013, FDA AS menyetujui Flublok, vaksin influenza perputaran lebih cepat yang merupakan yang pertama ditanam pada sel serangga dan bukan telur. Karena telur tidak digunakan dalam produksinya, ia menghindari masalah alergi telur.[48]
Meskipun sindrom Guillain-Barré telah dikhawatirkan sebagai komplikasi vaksinasi, CDC menyatakan bahwa sebagian besar penelitian tentang vaksin influenza modern tidak ada kaitannya dengan Guillain-Barré.[49][50] Infeksi dengan virus influenza itu sendiri meningkatkan risiko kematian (mencapai 1 dari 10.000) dan meningkatkan risiko pengembangan sindrom Guillain-Barré ke tingkat yang jauh lebih tinggi daripada tingkat tertinggi keterlibatan vaksin yang dicurigai (kira-kira 10 kali lebih tinggi pada perkiraan 2009) [51][52]
Meskipun satu review memberi insidensi sekitar satu kasus Guillain-Barré per juta vaksinasi,,[53] sebuah studi besar di China, yang dilaporkan dalam The New England Journal of Medicine yang mencakup hampir 100 juta dosis vaksin melawan H1N1 2009 "babi" Flu hanya menemukan sebelas kasus sindrom Guillain-Barré, (0,1 per juta dosis) jumlah kejadian pada orang yang divaksinasi, sebenarnya lebih rendah dari tingkat normal penyakit di China, dan tidak ada efek samping lain; "Rasio risiko-manfaat, yang merupakan vaksin dan segala sesuatu dalam dunia kedokteran, sangat mendukung vaksinasi." [52][54] Beberapa penelitian telah mengidentifikasi peningkatan kejadian narkolepsi di antara penerima pandemi influenza H1N1 ASO3- Vaksin adjuvanted,[55] upaya untuk mengidentifikasi mekanisme untuk ini menunjukkan bahwa narkolepsi adalah autoimun, dan bahwa vaksin ASO3-adjuvanted H1N1 dapat meniru hipokretin, berfungsi sebagai pemicu.[56]
Beberapa vaksin flu berbasis suntikan yang ditujukan untuk orang dewasa di Amerika Serikat mengandung thiomersal (juga dikenal sebagai thimerosal), pengawet berbasis merkuri. Meskipun ada beberapa kontroversi merkuri di media, [59] Komite Penasihat Global Organisasi Kesehatan Vaksin Dunia telah menyimpulkan bahwa tidak ada bukti toksisitas dari vaksin thiomersal dan tidak ada alasan mengenai alasan keamanan untuk beralih ke administrasi dosis tunggal yang lebih mahal.[57]
Proses pembuatan[sunting | sunting sumber]
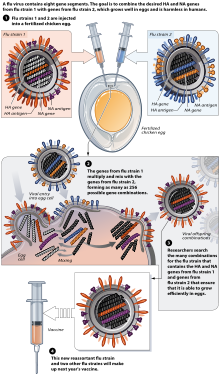
Vaksin flu biasanya diletakkan oleh produsen vaksin pada telur ayam yang dibuahi.[58][59] Di belahan bumi utara, proses pembuatannya dimulai setelah pengumuman (biasanya pada bulan Februari) strain yang direkomendasikan WHO untuk flu musim dingin.[58][60] Tiga strain (mewakili H1N1, H3N2, dan strain B) flu dipilih dan telur ayam diinokulasi secara terpisah, panen monovalen ini kemudian digabungkan untuk membuat vaksin trivalen.[61]

Pada November 2007, injeksi konvensional dan semprotan hidung dibuat dengan menggunakan telur ayam.[59] Uni Eropa juga telah menyetujui Optaflu, sebuah vaksin yang diproduksi oleh Novartis menggunakan sel binatang.[59] Teknik ini diharapkan bisa lebih terukur dan menghindari masalah dengan telur, seperti reaksi alergi dan ketidakcocokan dengan strain yang mempengaruhi unggas seperti ayam.[59] Penelitian berlanjut ke gagasan vaksin influenza "universal" yang tidak memerlukan penyesuaian pada strain tertentu, tetapi efektif terhadap berbagai macam virus influenza. Namun, tidak ada kandidat vaksin yang diumumkan pada November 2007.[59]
Sebuah vaksinasi berbasis DNA, yang diharapkan bisa lebih cepat diproduksi, seperti pada 2011 dalam uji klinis, yang menentukan keamanan dan kemanjuran.[62]
Pada tanggal 20 November 2012, Novartis menerima persetujuan FDA untuk vaksin kultur sel pertama.[63][64][65][66][67]
Dalam laporan tahun 2007, kapasitas global sekitar 826 juta dosis vaksin influenza musiman (tidak aktif dan hidup) dua kali lipat dari produksi 413 juta dosis. Dalam skenario agresif memproduksi vaksin pandemi influenza pada tahun 2013, hanya 2,8 miliar kursus yang dapat diproduksi dalam kerangka waktu enam bulan. Jika semua negara berpenghasilan tinggi dan menengah ke atas mencari vaksin untuk seluruh populasi mereka dalam sebuah pandemi, hampir 2 miliar kursus akan dibutuhkan. Jika China mengejar tujuan ini juga, lebih dari 3 miliar kursus dibutuhkan untuk melayani populasi ini.[68] Penelitian dan pengembangan vaksin terus berlanjut untuk mengidentifikasi pendekatan vaksin baru yang dapat menghasilkan vaksin dalam jumlah jauh lebih banyak dengan harga terjangkau bagi populasi global.
Metode pembuatan vaksin yang memakan kebutuhan telur termasuk pembangunan partikel mirip virus influenza (VLP). VLP menyerupai virus, tapi tidak perlu inaktivasi, karena tidak termasuk unsur pengkodean virus, tetapi hanya menghadirkan antigen dengan cara yang mirip dengan virion. Beberapa metode untuk memproduksi VLP meliputi kultur sel serangga Spodoptera frugiperda Sf9 dan produksi vaksin berbasis tanaman (misalnya, produksi di Nicotiana benthamiana). Ada bukti bahwa beberapa VLP memperoleh antibodi yang mengenali panel yang lebih luas dari isolat virus yang berbeda secara antigen dibandingkan dengan vaksin lain dalam penghambat hemaglutinasi (HIA).[69]
Vaksin influenza diproduksi pada telur bebas patogen yang berumur 11 sampai 12 hari.[70] Bagian atas telur didesinfeksi dengan membersihkan dengan alkohol dan kemudian telur tersebut dinyalakan untuk mengidentifikasi area non-vena di rongga allantoic dimana lubang kecil ditusuk untuk dijadikan pelepasan tekanan.[71] Lubang kedua dibuat di bagian atas telur, dimana virus influenza disuntikkan ke dalam rongga allantoic, melewati membran chorioallantoic. Kedua lubang tersebut kemudian disegel dengan parafin meleleh dan telur yang diinokulasi diinkubasi selama 48 jam pada suhu 37 derajat celcius.[70] Selama masa inkubasi, virus bereplikasi dan virus yang baru direplikasi dilepaskan ke cairan allantoic [72]
Setelah periode inkubasi selama 48 jam, bagian atas telur retak dan 10 mililiter cairan allantoic dikeluarkan, dimana sekitar 15 mikrogram vaksin flu dapat diperoleh. Pada titik ini, virus telah melemah atau terbunuh dan antigen virus dimurnikan dan ditempatkan di dalam botol, semprotan, atau penyemprot hidung.[72] Selesai dalam skala besar, metode ini digunakan untuk menghasilkan vaksin flu untuk populasi manusia.
Sejarah[sunting | sunting sumber]
Vaksin digunakan baik pada manusia maupun bukan manusia. Vaksin manusia dimaksudkan kecuali diidentifikasi secara khusus sebagai dokter hewan, unggas atau vaksin ternak.
Asal dan perkembangan[sunting | sunting sumber]
Dalam pandemi flu Spanyol pada tahun 1918, "Dokter mencoba semua yang mereka ketahui, semua yang pernah mereka dengar, dari seni kuno pasien pendarahan, pemberian oksigen, pengembangan vaksin dan sera baru (terutama mengenai apa yang sekarang kita sebut Hemophilus influenzae - sebuah nama yang berasal dari fakta bahwa pada awalnya dianggap sebagai agen etiologi - dan beberapa jenis pneumokokus). Hanya satu ukuran terapeutik, yang menularkan darah dari pasien yang sembuh ke korban baru,tidak menunjukkan sedikit pun keberhasilan. "[73]
Pada tahun 1931, pertumbuhan virus pada telur ayam embrio dilaporkan oleh Ernest William Goodpasture dan rekan-rekannya di Vanderbilt University. Pekerjaan tersebut diperluas ke pertumbuhan virus influenza oleh beberapa pekerja, termasuk Thomas Francis, Jonas Salk, Wilson Smith dan Macfarlane Burnet, yang mengarah ke vaksin influenza eksperimental pertama.[74] Pada tahun 1940-an, militer AS mengembangkan vaksin influenza yang pertama disetujui untuk influenza, yang digunakan dalam Perang Dunia Kedua.[75] Telur terus digunakan untuk memproduksi virus yang digunakan dalam vaksin influenza, tetapi produsen melakukan perbaikan dalam kemurnian virus dengan mengembangkan proses yang lebih baik untuk menghilangkan protein telur dan untuk mengurangi reaktivitas sistemik terhadap vaksin tersebut.[76] Baru-baru ini, FDA AS telah menyetujui vaksin influenza yang dibuat dengan menumbuhkan virus dalam kultur sel [77] dan vaksin influenza yang dibuat dari protein rekombinan [78] telah disetujui, dengan vaksin influenza berbasis tanaman diuji dalam uji klinis.[79]
Penerimaan[sunting | sunting sumber]
Menurut CDC: "Vaksinasi influenza adalah metode utama untuk mencegah influenza dan komplikasi parah. [...] Vaksinasi dikaitkan dengan penurunan penyakit pernapasan terkait influenza dan kunjungan dokter di antara semua kelompok usia, rawat inap dan kematian di antara orang-orang dengan Risiko tinggi, otitis media di kalangan anak-anak, dan ketidakhadiran kerja di antara orang dewasa. Meskipun tingkat vaksinasi influenza meningkat secara substansial selama tahun 1990an, diperlukan perbaikan lebih lanjut pada tingkat cakupan vaksin.[80]
Teknologi berbasis telur (masih digunakan pada tahun 2005) untuk memproduksi vaksin influenza diciptakan pada tahun 1950an.[81] Dalam ketakutan flu babi A.S. pada tahun 1976, Presiden Gerald Ford dihadapkan pada potensi pandemi flu babi. Program vaksinasi dilarikan, tetapi terganggu oleh penundaan dan masalah hubungan masyarakat. Sementara itu, upaya penahanan militer maksimum berhasil secara tak terduga dalam membatasi strain baru ke basis tentara tunggal di mana ia berasal. Di pangkalan itu sejumlah tentara jatuh sakit parah, tapi hanya satu yang meninggal. Program ini dibatalkan, setelah sekitar 24% dari populasi telah menerima vaksinasi. Kelebihan kematian dua puluh lima di atas tingkat tahunan normal serta 400 rawat inap yang berlebihan, baik dari sindrom Guillain-Barré, diperkirakan telah terjadi dari program vaksinasi itu sendiri, yang menggambarkan bahwa vaksin itu sendiri tidak bebas dari risiko. Hasilnya telah dikutip untuk memicu keraguan terhadap vaksinasi.[82] Pada akhirnya, vaksin 1960 yang mungkin telah menyelamatkan nyawa. Sebuah penelitian pada tahun 2010 menemukan respon kekebalan yang meningkat secara signifikan terhadap pandemi H1N1 2009 pada peserta studi yang telah menerima vaksinasi melawan flu babi pada tahun 1976.[83]
Referensi[sunting | sunting sumber]
- ^ a b c d e f g "Vaccines against influenza WHO position paper – November 2012" (PDF). Wkly Epidemiol Rec. 87 (46): 461–76. Nov 23, 2012. PMID 23210147.
- ^ Manzoli L, Ioannidis JP, Flacco ME, De Vito C, Villari P (July 2012). "Effectiveness and harms of seasonal and pandemic influenza vaccines in children, adults and elderly: a critical review and re-analysis of 15 meta-analyses". Hum Vaccin Immunother. 8 (7): 851–62. doi:10.4161/hv.19917. PMC 3495721
 . PMID 22777099.
. PMID 22777099.
- ^ a b c Osterholm, MT; Kelley, NS; Sommer, A; Belongia, EA (Jan 2012). "Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis". The Lancet. Infectious diseases. 12 (1): 36–44. doi:10.1016/S1473-3099(11)70295-X. PMID 22032844.
- ^ Jefferson, T; Di Pietrantonj, C; Al-Ansary, LA; Ferroni, E; Thorning, S; Thomas, RE (Feb 17, 2010). "Vaccines for preventing influenza in the elderly". The Cochrane database of systematic reviews (2): CD004876. doi:10.1002/14651858.CD004876.pub3. PMID 20166072.
- ^ a b c d Jefferson T, Rivetti A, Di Pietrantonj C, Demicheli V, Ferroni E (2012). "Vaccines for preventing influenza in healthy children". Cochrane Database Syst Rev. 8: CD004879. doi:10.1002/14651858.CD004879.pub4. PMID 22895945.
- ^ a b c "Who Should Get Vaccinated Against Influenza". U.S. Centers for Disease Control and Prevention. 2015-11-04. Diakses tanggal 2015-12-08.
- ^ "Factsheet for the general public". ecdc.europa.eu. Diakses tanggal 30 December 2016.
- ^ Compans, Richard W. (2009). Vaccines for pandemic influenza. Dordrecht: Springer. hlm. 49. ISBN 9783540921653.
- ^ Vaccine Analysis: Strategies, Principles, and Control. Springer. 2014. hlm. 61. ISBN 9783662450246.
- ^ "WHO Model List of Essential Medicines (19th List)" (PDF). World Health Organization. April 2015. Diakses tanggal 8 December 2016.
- ^ "Vaccine, influenza". International Drug Price Indicator Guide. Diakses tanggal 6 December 2015.[pranala nonaktif permanen]
- ^ Hamilton, Richart (2015). Tarascon Pocket Pharmacopoeia 2015 Deluxe Lab-Coat Edition. Jones & Bartlett Learning. hlm. 314. ISBN 9781284057560.
- ^ Center for Disease Control and Prevention. "Key Facts About Seasonal Flu Vaccine". Diakses tanggal 7 February 2013.
- ^ a b "Key Facts About Seasonal Flu Vaccine".
- ^ Osterholm, Michael T; Kelley, Nicholas S; Sommer, Alfred; Belongia, Edward A (2012). "Efficacy and effectiveness of influenza vaccines: A systematic review and meta-analysis". The Lancet Infectious Diseases. 12 (1): 36–44. doi:10.1016/s1473-3099(11)70295-x. PMID 22032844.
- ^ Fedson, D. S. (1998). "Measuring protection: Efficacy versus effectiveness". Developments in biological standardization. 95: 195–201. PMID 9855432.
- ^ a b c d e f Demicheli, Vittorio; Jefferson, Tom; Al-Ansary, Lubna A; Ferroni, Eliana; Rivetti, Alessandro; Di Pietrantonj, Carlo (2014). "Vaccines for preventing influenza in healthy adults". Cochrane Database of Systematic Reviews (3): CD001269. doi:10.1002/14651858.CD001269.pub5. PMID 24623315.
- ^ Stephenson, I.; Zambon, M. C.; Rudin, A.; Colegate, A.; Podda, A.; Bugarini, R.; Del Giudice, G.; Minutello, A.; Bonnington, S.; Holmgren, J.; Mills, K. H. G.; Nicholson, K. G. (2006). "Phase I Evaluation of Intranasal Trivalent Inactivated Influenza Vaccine with Nontoxigenic Escherichia coli Enterotoxin and Novel Biovector as Mucosal Adjuvants, Using Adult Volunteers". Journal of Virology. 80 (10): 4962–70. doi:10.1128/JVI.80.10.4962-4970.2006. PMC 1472052
 . PMID 16641287.
. PMID 16641287.
- ^ Jefferson, T. (2006). "Influenza vaccination: Policy versus evidence". BMJ. 333 (7574): 912–5. doi:10.1136/bmj.38995.531701.80. PMC 1626345
 . PMID 17068038.
. PMID 17068038.
- ^ "2007-2008 Influenza (Flu) Season". CDC. June 26, 2008.
- ^ Treanor, John J; Kotloff, Karen; Betts, Robert F; Belshe, Robert; Newman, Fran; Iacuzio, Dominick; Wittes, Janet; Bryant, Martin (1999). "Evaluation of trivalent, live, cold-adapted (CAIV-T) and inactivated (TIV) influenza vaccines in prevention of virus infection and illness following challenge of adults with wild-type influenza A (H1N1), A (H3N2), and B viruses". Vaccine. 18 (9–10): 899–906. doi:10.1016/S0264-410X(99)00334-5. PMID 10580204.
- ^ a b Jefferson, Tom; Di Pietrantonj, Carlo; Al-Ansary, Lubna A; Ferroni, Eliana; Thorning, Sarah; Thomas, Roger E (2010). "Vaccines for preventing influenza in the elderly". Cochrane Database of Systematic Reviews (2): CD004876. doi:10.1002/14651858.CD004876.pub3. PMID 20166072.
- ^ Jefferson, T; Rivetti, D; Rivetti, A; Rudin, M; Di Pietrantonj, C; Demicheli, V (2005). "Efficacy and effectiveness of influenza vaccines in elderly people: A systematic review". The Lancet. 366 (9492): 1165–74. doi:10.1016/S0140-6736(05)67339-4. PMID 16198765.
- ^ a b "Influenza (Seasonal)". World Health Organization. November 2016.
- ^ a b Burls, A; Jordan, R; Barton, P; Olowokure, B; Wake, B; Albon, E; Hawker, J (2006). "Vaccinating healthcare workers against influenza to protect the vulnerable—Is it a good use of healthcare resources? A systematic review of the evidence and an economic evaluation". Vaccine. 24 (19): 4212–21. doi:10.1016/j.vaccine.2005.12.043. PMID 16546308.
- ^ Ahmed, F.; Lindley, M. C.; Allred, N.; Weinbaum, C. M.; Grohskopf, L. (2013). "Effect of Influenza Vaccination of Healthcare Personnel on Morbidity and Mortality Among Patients: Systematic Review and Grading of Evidence". Clinical Infectious Diseases. 58 (1): 50–7. doi:10.1093/cid/cit580. PMID 24046301.
- ^ Griffin, M. R. (2013). "Editorial Commentary: Influenza Vaccination of Healthcare Workers: Making the Grade for Action". Clinical Infectious Diseases. 58 (1): 58–60. doi:10.1093/cid/cit590. PMID 24046312.
- ^ Simonsen, Lone; Viboud, Cecile; Taylor, Robert J.; Miller, Mark A.; Jackson, Lisa (2009). "Influenza vaccination and mortality benefits: New insights, new opportunities". Vaccine. 27 (45): 6300–4. doi:10.1016/j.vaccine.2009.07.008. PMID 19840664.
- ^ Darvishian, Maryam; Bijlsma, Maarten J; Hak, Eelko; Van Den Heuvel, Edwin R (2014). "Effectiveness of seasonal influenza vaccine in community-dwelling elderly people: A meta-analysis of test-negative design case-control studies". The Lancet Infectious Diseases. 14 (12): 1228–39. doi:10.1016/S1473-3099(14)70960-0. PMID 25455990.
- ^ Nichol, Kristin L.; Nordin, James D.; Nelson, David B.; Mullooly, John P.; Hak, Eelko (2007). "Effectiveness of Influenza Vaccine in the Community-Dwelling Elderly". New England Journal of Medicine. 357 (14): 1373–81. doi:10.1056/NEJMoa070844. PMID 17914038.
- ^ Simonsen, Lone; Taylor, Robert J; Viboud, Cecile; Miller, Mark A; Jackson, Lisa A (2007). "Mortality benefits of influenza vaccination in elderly people: An ongoing controversy". The Lancet Infectious Diseases. 7 (10): 658–66. doi:10.1016/S1473-3099(07)70236-0. PMID 17897608.
- ^ Thompson, William W.; Shay, D. K.; Weintraub, E; Brammer, L; Cox, N; Anderson, L. J.; Fukuda, K (2003). "Mortality Associated with Influenza and Respiratory Syncytial Virus in the United States". JAMA. 289 (2): 179–86. doi:10.1001/jama.289.2.179. PMID 12517228.
- ^ "High Dose Flu Vaccine for the Elderly « Science-Based Medicine". Sciencebasedmedicine.org. Diakses tanggal October 17, 2013.
- ^ "CDC – Seasonal Influenza (Flu) – Q & A: Fluzone High-Dose Seasonal Influenza Vaccine". Cdc.gov. August 13, 2013. Diakses tanggal October 17, 2013.
- ^ Haverkate, M; d'Ancona, F; Giambi, C; Johansen, K; Lopalco, P. L.; Cozza, V; Appelgren, E; VENICE project gatekeepers contact points (2012). "Mandatory and recommended vaccination in the EU, Iceland and Norway: Results of the VENICE 2010 survey on the ways of implementing national vaccination programmes". Euro surveillance. 17 (22). PMID 22687916.
- ^ Field, R. I. (2009). "Mandatory vaccination of health care workers: Whose rights should come first?". P & T. 34 (11): 615–8. PMC 2810172
 . PMID 20140133.
. PMID 20140133.
- ^ Kassianos, George (2015). "Willingness of European healthcare workers to undergo vaccination against seasonal influenza: Current situation and suggestions for improvement". Drugs in Context. 4: 212268. doi:10.7573/dic.212268. PMC 4316812
 . PMID 25657810.
. PMID 25657810.
- ^ Thomas, Roger E; Jefferson, Tom; Lasserson, Toby J (2016). "Influenza vaccination for healthcare workers who care for people aged 60 or older living in long-term care institutions". Cochrane Database of Systematic Reviews (6): CD005187. doi:10.1002/14651858.CD005187.pub5. PMID 27251461.
- ^ Fell, Deshayne B.; Sprague, Ann E.; Liu, Ning; Yasseen, Abdool S.; Wen, Shi-Wu; Smith, Graeme; Walker, Mark C. (2012). "H1N1 Influenza Vaccination During Pregnancy and Fetal and Neonatal Outcomes". American Journal of Public Health. 102 (6): e33–40. doi:10.2105/AJPH.2011.300606. PMC 3483960
 . PMID 22515877.
. PMID 22515877.
- ^ Madhi, Shabir A.; Cutland, Clare L.; Kuwanda, Locadiah; Weinberg, Adriana; Hugo, Andrea; Jones, Stephanie; Adrian, Peter V.; Van Niekerk, Nadia; Treurnicht, Florette; Ortiz, Justin R.; Venter, Marietjie; Violari, Avy; Neuzil, Kathleen M.; Simões, Eric A.F.; Klugman, Keith P.; Nunes, Marta C. (2014). "Influenza Vaccination of Pregnant Women and Protection of Their Infants". New England Journal of Medicine. 371 (10): 918–31. doi:10.1056/NEJMoa1401480. PMID 25184864.
- ^ "Key Facts About Seasonal Flu Vaccine". cdc.gov. Center for Disease Control. Diakses tanggal 26 September 2014.
- ^ "CDC – Inactivated Influenza Vaccine 2007–2008 – What You Need To Know" (PDF).
- ^ "Flu – LAIV" (PDF).
- ^ Gagnon, Remi; Primeau, Marie Noel; Des Roches, Anne; Lemire, Chantal; Kagan, Rhoda; Carr, Stuart; Ouakki, Manale; Benoît, Mélanie; De Serres, Gaston (2010). "Safe vaccination of patients with egg allergy with an adjuvanted pandemic H1N1 vaccine". Journal of Allergy and Clinical Immunology. 126 (2): 317–23. doi:10.1016/j.jaci.2010.05.037. PMID 20579720.
- ^ National Advisory Committee on Immunization (August 2012). "Statement on Seasonal Influenza Vaccine for 2012–2013" (PDF). Canadian Communicable Disease Report. 38. Diarsipkan dari versi asli (PDF) tanggal 2013-01-17. Diakses tanggal 18 July 2013.
- ^ Turner, Paul J; Southern, Jo; Andrews, Nick J; Miller, Elizabeth; Erlewyn-Lajeunesse, Michel (2015). "Safety of live attenuated influenza vaccine in young people with egg allergy: Multicentre prospective cohort study". BMJ. 351: h6291. doi:10.1136/bmj.h6291. PMC 4673102
 . PMID 26645895.
. PMID 26645895.
- ^ Greenhawt, Matthew (2015). "Live attenuated influenza vaccine for children with egg allergy". BMJ. 351: h6656. doi:10.1136/bmj.h6656. PMID 26657778.
- ^ Andrew Pollack, "Rapidly Produced Flu Vaccine Wins F.D.A. Approval", The New York Times, January 16, 2013
- ^ Haber, Penina; Sejvar, James; Mikaeloff, Yann; Destefano, Frank (2009). "Vaccines and Guillain-Barré Syndrome". Drug Safety. 32 (4): 309–23. doi:10.2165/00002018-200932040-00005. PMID 19388722.
- ^ Kaplan, J. E. (1982). "Guillain-Barre syndrome in the United States, 1979-1980 and 1980-1981. Lack of an association with influenza vaccination". JAMA. 248 (6): 428. doi:10.1001/jama.248.6.698. PMID 25996397.
- ^ Stowe, J.; Andrews, N.; Wise, L.; Miller, E. (2008). "Investigation of the Temporal Association of Guillain-Barre Syndrome with Influenza Vaccine and Influenzalike Illness Using the United Kingdom General Practice Research Database". American Journal of Epidemiology. 169 (3): 382–8. doi:10.1093/aje/kwn310. PMID 19033158.
- ^ a b Sivadon‐Tardy, Valérie; Orlikowski, David; Porcher, Raphaël; Sharshar, Tarek; Durand, Marie‐Christine; Enouf, Vincent; Rozenberg, Flore; Caudie, Christiane; Annane, Djillali; Van Der Werf, Sylvie; Lebon, Pierre; Raphaël, Jean‐Claude; Gaillard, Jean‐Louis; Gault, Elyanne (2009). "Guillain‐Barré Syndrome and Influenza Virus Infection". Clinical Infectious Diseases. 48 (1): 48–56. doi:10.1086/594124. PMID 19025491.
- ^ Vellozzi, Claudia; Burwen, Dale R.; Dobardzic, Azra; Ball, Robert; Walton, Kimp; Haber, Penina (2009). "Safety of trivalent inactivated influenza vaccines in adults: Background for pandemic influenza vaccine safety monitoring". Vaccine. 27 (15): 2114–20. doi:10.1016/j.vaccine.2009.01.125. PMID 19356614.
- ^ Steven Reinberg (February 2, 2011). "Last Year's H1N1 Flu Vaccine Was Safe, Study Finds". U.S. News & World Report.
- ^ TECHNICAL REPORT: Narcolepsy in association with pandemic influenza vaccination (PDF). Stockholm, Sweden: European Centre for Disease Prevention and Contro. 2012. ISBN 978-92-9193-388-4. Diarsipkan dari versi asli (PDF) tanggal 2013-12-31. Diakses tanggal 2017-06-23.
- ^ Yong, Ed (2013). "Narcolepsy confirmed as autoimmune disease". Nature. doi:10.1038/nature.2013.14413.
- ^ Global Advisory Committee on Vaccine Safety (2006-07-14). "Thiomersal and vaccines". World Health Organization. Diakses tanggal 2007-11-20.
- ^ a b "how it's made" (PDF). Diarsipkan dari versi asli (PDF) tanggal 2010-07-05.
- ^ a b c d e New and Old Ways to Make Flu Vaccines, November 8, 2007, National Public Radio.
- ^ "World Health Organization".
- ^ "Recommendations for the production and control of influenza vaccine (inactivated)" (PDF). World Health Organization. Diakses tanggal 27 May 2013.
- ^ "Priming with DNA vaccine makes avian flu vaccine work better (NIH News)". October 3, 2011.
- ^ "Novartis receives FDA approval for Flucelvax, the first cell-culture vaccine in US to help protect against seasonal influenza" (Siaran pers). Novartis. November 20, 2012. Diarsipkan dari versi asli tanggal November 28, 2012. "Salinan arsip". Diarsipkan dari versi asli tanggal 2012-11-28. Diakses tanggal 2017-06-23.
- ^ ""FDA approves first seasonal influenza vaccine manufactured using cell culture technology"".
- ^ Research, Center for Biologics Evaluation and. "Approved Products - November 20, 2012 Approval Letter- Flucelvax".
- ^ "Seqirus receives FDA approval for Flucelvax Quadrivalent (Influenza Vaccine) for people four years of age and older" (Siaran pers). Seqirus. May 23, 2016. "Salinan arsip". Archived from the original on 2017-01-16. Diakses tanggal 2017-06-23.
- ^ "FDA approves first seasonal influenza vaccine manufactured using cell culture technology" (Siaran pers). U.S. Food and Drug Administration (FDA). November 20, 2012.
- ^ PATH, Oliver Wyman. Influenza Vaccine Strategies for Broad Global Access. 2007. "Archived copy" (PDF). Diarsipkan dari versi asli (PDF) tanggal January 25, 2009. Diakses tanggal September 16, 2009.
- ^ Bright, Rick A.; Carter, Donald M.; Daniluk, Shannon; Toapanta, Franklin R.; Ahmad, Attiya; Gavrilov, Victor; Massare, Mike; Pushko, Peter; Mytle, Nutan; Rowe, Thomas; Smith, Gale; Ross, Ted M. (2007). "Influenza virus-like particles elicit broader immune responses than whole virion inactivated influenza virus or recombinant hemagglutinin". Vaccine. 25 (19): 3871–8. doi:10.1016/j.vaccine.2007.01.106. PMID 17337102.
- ^ a b Racaniello, Vincent (Dec 2009). "Influenza virus growth in eggs". Virology Blog.
- ^ Izzat, Fakhrul (Apr 2012). "Viral Cultivation in Chicken Embryo". Youtube.
- ^ a b "How Influenza (Flu) Vaccines Are Made". Centers for Disease Control and Prevention. May 2014.
- ^ The Threat of Pandemic Influenza: Are We Ready? Workshop Summary (2005) (free online book)[pranala nonaktif permanen] page 62
- ^ Plotkin, S.L. and Plotkin, S.A. "A short history of vaccination." In: Vaccines, Stanley A. Plotkin, Walter A. Orenstein, Paul A. Offit, eds. Elsevier Health Sciences, 2008, pp. 6–7.
- ^ Artenstein, A.W. "Influenza" In: Vaccines: A Biography Andrew W. Artenstein, ed. pp. 191–205.
- ^ Hampson, A. W. (2008). "Vaccines for pandemic influenza. The history of our current vaccines, their limitations and the requirements to deal with a pandemic threat". Annals of the Academy of Medicine, Singapore. 37 (6): 510–7. PMID 18618064.
- ^ USFDA FDA approves first seasonal influenza vaccine manufactured using cell culture technology. November 20, 2012.
- ^ USFDA FDA approves new seasonal influenza vaccine made using novel technology. Jan. 16, 2013.
- ^ Landry, Nathalie; Ward, Brian J.; Trépanier, Sonia; Montomoli, Emanuele; Dargis, Michèle; Lapini, Giulia; Vézina, Louis-P. (2010). "Preclinical and Clinical Development of Plant-Made Virus-Like Particle Vaccine against Avian H5N1 Influenza". PLoS ONE. 5 (12): e15559. Bibcode:2010PLoSO...515559L. doi:10.1371/journal.pone.0015559. PMC 3008737
 . PMID 21203523.
. PMID 21203523.
- ^ CDC report Prevention and Control of Influenza published April 12, 2002.
- ^ Osterholm, Michael T. (2005). "Preparing for the Next Pandemic". New England Journal of Medicine. 352 (18): 1839–42. doi:10.1056/NEJMp058068. PMID 15872196.
- ^ "Swine Flu Epidemics". October 9, 1999. Diarsipkan dari versi asli tanggal October 9, 1999.
- ^ McCullers, Jonathan A.; Van De Velde, Lee‐Ann; Allison, Kim J.; Branum, Kristen C.; Webby, Richard J.; Flynn, Patricia M. (2010). "Recipients of Vaccine against the 1976 "Swine Flu" Have Enhanced Neutralization Responses to the 2009 Novel H1N1 Influenza Virus". Clinical Infectious Diseases. 50 (11): 1487–92. doi:10.1086/652441. PMC 2946351
 . PMID 20415539.
. PMID 20415539.

