Uranium heksaklorida
| |
| Nama | |
|---|---|
| Nama IUPAC
Uranium(VI) klorida
| |
| Nama lain
Uranium heksaklorida
Perurani klorida | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| |
| |
| Sifat | |
| UCl 6 | |
| Massa molar | 450,745 g/mol |
| Penampilan | Padatan kristalin hijau tua |
| Densitas | 3600 kg/m3 |
| Titik lebur | 177 °C (351 °F; 450 K) |
| Senyawa terkait | |
Anion lain
|
Uranium heksafluorida |
Kation lainnya
|
Wolfram heksaklorida |
Related Uranium klorida
|
|
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Uranium heksaklorida (UCl
6) adalah sebuah senyawa kimia anorganik dari uranium dalam keadaan oksidasi +6.[1][2] UCl
6 merupakan halida logam yang terdiri dari uranium dan klorin. Senyawa ini adalah padatan kristalin hijau tua multi-luminesen dengan tekanan uap antara 1-3 mmHg pada suhu 373,15 K.[3] UCl
6 stabil dalam vakum, udara kering, nitrogen, dan helium pada suhu kamar. Ia larut dalam karbon tetraklorida (CCl
4). Dibandingkan dengan uranium halida lainnya, hanya sedikit yang diketahui mengenai UCl
6.
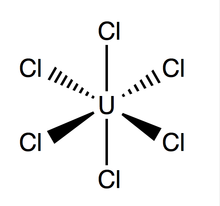
Struktur dan ikatan[sunting | sunting sumber]
Uranium heksaklorida memiliki geometri oktahedral, dengan grup titik Oh. Kisi senyawa ini (dimensi: 10,95 ± 0,02 Å × 6,03 ± 0,01 Å) berbentuk heksagonal dengan tiga molekul per sel; ikatan U–Cl teoretis rata-rata adalah 2,472 Å (panjang U–Cl eksperimental yang ditemukan melalui difraksi sinar-X adalah 2,42 Å),[4] dan jarak antara dua atom klorin yang berdekatan adalah 3,65 Å.
Sifat kimia[sunting | sunting sumber]
Uranium heksaklorida adalah senyawa yang sangat higroskopis dan mudah terurai ketika terpapar pada kondisi atmosfer biasa.[5] Oleh karena itu, senyawa ini harus ditangani dalam alat vakum atau dalam kotak kering.
Dekomposisi termal[sunting | sunting sumber]
UCl
6 stabil hingga suhu antara 120 °C dan 150 °C. Dekomposisi UCl
6 menghasilkan transisi fase padat dari satu bentuk kristal UCl
6 ke bentuk lain yang lebih stabil.[6] Namun, penguraian gas UCl
6 menghasilkan UCl
5. Energi aktivasi untuk reaksi ini adalah sekitar 40 kcal per mol.
- 2 UCl
6 (g) → 2 UCl
5 (s) + Cl
2 (g)
Kelarutan[sunting | sunting sumber]
UCl
6 bukanlah senyawa yang sangat mudah larut. Senyawa ini larut dalam CCl
4 untuk menghasilkan larutan berwarna cokelat. Ia sedikit larut dalam isobutil bromida dan fluorokarbon (C
7F
16).[6]
| Pelarut | Suhu (°C) | Gram UCl 6/100 g larutan |
|---|---|---|
| CCl 4 |
−18 | 2,64 |
| CCl 4 |
0 | 4,9 |
| CCl 4 |
20 | 7,8 |
| 6,6% Cl 2 : 93,4% CCl 4 |
−20 | 2,4 |
| 12,5% Cl 2 : 87,5% CCl 4 |
−20 | 2,23 |
| 12,5% Cl 2 : 87,5% CCl 4 |
0 | 3,98 |
| Cl 2 cair |
−33 | 2,20 |
| CH 3Cl |
−24 | 1,16 |
| Benzena | 80 | Tak larut |
| Freon 113 | 45 | 1,83 |
Reaksi dengan hidrogen fluorida[sunting | sunting sumber]
Ketika UCl
6 direaksikan dengan hidrogen fluorida (HF) cair anhidrat yang dimurnikan pada suhu kamar, ia akan menghasilkan UF
5.[6]
- 2 UCl
6 + 10 HF → 2 UF
5 + 10 HCl + Cl
2
Sintesis[sunting | sunting sumber]
Uranium heksaklorida dapat disintesis dari reaksi antara uranium trioksida (UO
3) dengan campuran CCl
4 cair dan klorin (Cl
2) panas. Hasil dapat ditingkatkan jika reaksi dilakukan dengan adanya UCl
5.[7] UO
3 diubah menjadi UCl
5, yang kemudian bereaksi dengan Cl
2 berlebih membentuk UCl
6. Dibutuhkan sejumlah besar panas agar reaksi ini dapat berlangsung; kisaran suhu mulai dari 65 °C hingga 170 °C, tergantung pada jumlah reaktan (suhu ideal 100 °C - 125 °C). Reaksi ini dilakukan dalam bejana kedap gas tertutup (misalnya kotak sarung tangan) yang dapat menahan tekanan yang terbentuk.
Langkah 1: 2 UO
3 + 5 Cl
2 → 2 UCl
5 + 3 O
2
Langkah 2: 2 UCl
5 + Cl
2 → 2 UCl
6
Reaksi keseluruhan: 2 UO
3 + 6 Cl
2 → 2 UCl
6 + 3 O
2
Heksahalida logam ini juga dapat disintesis dengan mengembuskan gas Cl
2 ke UCl
4 yang disublimasikan pada suhu 350 °C.[8]
Langkah 1: 2 UCl
4 + Cl
2 → 2 UCl
5
Langkah 2: 2 UCl
5 + Cl
2 → 2 UCl
6
Reaksi keseluruhan: UCl
4 + Cl
2 → UCl
6
Referensi[sunting | sunting sumber]
- ^ Zachariasen, W. H. (1948). "Crystal chemical studies of the 5f-series of elements. V. The crystal structure of uranium hexachloride". Acta Crystallographica. 1 (6): 285–287. doi:10.1107/S0365110X48000788
 .
.
- ^ Taylor, J. C.; Wilson, P. W. (1974). "Neutron and X-ray powder diffraction studies of the structure of uranium hexachloride". Acta Crystallographica Section B. 30 (6): 1481. doi:10.1107/S0567740874005115.
- ^ Van Dyke, R. E.; Evers, E. C. (1955). "Preparation of Uranium Hexachloride". Google Patents: 2.
- ^ Batista, E. R.; Martin, R. L.; Hay, P. J. (2004). "Density Functional Investigations of the Properties and Thermodynamics of UFn and UCln (n=1,...,6)". J. Chem. Phys. 121 (22): 11104–11. doi:10.1063/1.1811607. PMID 15634063.
- ^ Lipkin, D.; Wessman, S. (1955). "Process and Apparatus for protecting Uranium hexachloride from Deterioration and Contamination". Google Patents: 2.
- ^ a b c Katz, J.J.; Rabinowitch,E. (1951). The Chemistry of Uranium. Ann Arbor: The McGraw-Hill Book Company.
- ^ Van Dyke, R. E.; Evers, E. C. (1955). "Preparation of Uranium Hexachloride". Google Patents: 2.
- ^ Thornton, G.; Edelstein, N.; Rösch, N.; Woodwark, D.R.; Edgell, R.G. (1979). "The Electronic Structure of UCl6: Photoelectron Spectra and Scattered Wave Xα Calculations". J. Chem. Phys. 70 (11): 6. Bibcode:1979JChPh..70.5218T. doi:10.1063/1.437313.
