Struktur kimia

Struktur kimia adalah suatu pemodelan struktur senyawa kimia yang memberikan informasi tentang bagaimana suatu atom yang berbeda membentuk suatu molekul, atau agregat atom. Informasi ini termasuk geometri molekul, konfigurasi elektron dan, jika sesuai, struktur kristal.[1][2]
Geometri molekul mengacu pada urutan spasial atom dalam molekul (termasuk panjang ikatan dan sudut ikatan) serta ikatan kimia yang memegang atom bersama-sama. Geometri molekul harus menjelaskan bentuk molekul paling sederhana seperti oksigen atau nitrogen, yang lebih kompleks, seperti molekul protein atau DNA.[3][4] Dengan istilah ini kita juga bisa merujuk pada struktur di mana tidak ada molekul itu sendiri. Senyawa ionik atau kovalen tidak membentuk molekul namun membentuk jaringan tiga dimensi, agregat besar atom atau ion, dengan struktur reguler, simetris dan periodik.
Begitu struktur kimia dari suatu molekul dikenal atau diasumsikan, adalah mungkin untuk mewakilinya dengan menggunakan model bola molekuler seperti model bola-dan-pasak atau model ruang terisi.[5]
| Molekul | Atom | Ion | Logam |
|---|---|---|---|
|
|
|
|
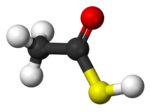
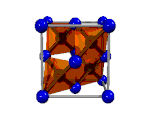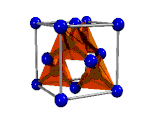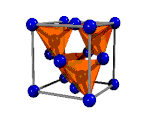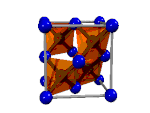
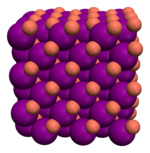
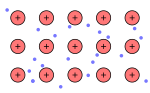
| Asam tioasetat, CH3-COSH | Intan, Cn | Tembaga(I) Iodida, CuI2 | Logam |
| Ikatan kovalen molekul | Ikatan kovalen retikuler | Ikatan ionik | Ikatan logam |
Geometri molekul kovalen[sunting | sunting sumber]
Pengaturan spasial atom dalam molekul tertentu adalah salah satu yang memungkinkan pembentukan ikatan antara atom-atom ini dengan tolakan sekecil apapun di antara awan elektron mereka, yang cenderung bergerak sejauh mungkin satu sama lain. Teori tolakan pasangan kulit elektron valensi (teori VSEPR) memberikan prediksi perkiraan bentuk atau struktur dari banyak molekul tunggal dari pasangan elektron bersama dan pasangan elektron bebas pada masing-masing atom pusat.[1]
Geometri molekuler suatu senyawa kimia dapat digambarkan secara kasar oleh rumus struktur, dengan menggunakan model 2D dan 3D.
Konfigurasi elektron menggambarkan distribusi elektron atom antara tingkat dan sub-level energi yang berbeda serta pendudukan orbital molekul senyawa.
Geometri dan struktur molekul sederhana[sunting | sunting sumber]
Teori VSEPR memberikan pendekatan yang baik dari bentuk dan struktur banyak molekul, yang dilengkapi dengan input lain seperti teori hibridisasi atau teori orbital hibrida (OH).
Tabel di bawah menunjukkan beberapa molekul sederhana, dengan beberapa bentuk yang paling umum.
| Molekul linear | Molekul angular | Molekul planar | Molekul piramidal | Molekul tetrahedral |
|---|---|---|---|---|

|
|

|
|
|
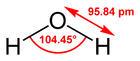
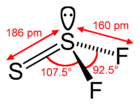
| Molekul karbonil sulfida, S=C=O | Molekul air, H2O | Molekul boron trifluorida, BF3, menunjukkan mode vibrasi | Molekul tiotionil, S2F2 | Molekul silikon tetrafluorida, SiF4 |
| Dua ikatan rangkap dua | 4 PE | 3 PE | 4 PE | 4 PE |
Jelas, ketika jumlah atom dalam molekul meningkat, kompleksitas strukturnya meningkat dan kesulitan penentuannya meningkat. Beberapa molekul yang strukturnya sulit ditentukan adalah sebagai berikut.
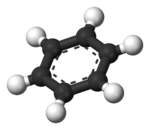
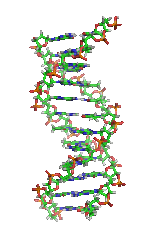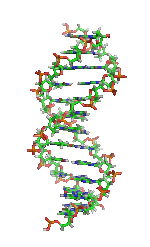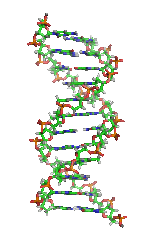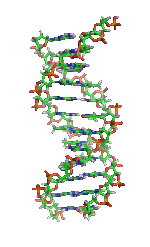
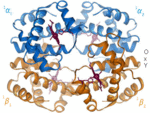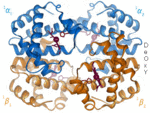
| Benzena | Heliks α (protein) | DNA | Hemoglobin |
|---|---|---|---|
|

|
|
|
| Kekulé (1865)[6][7] | Pauling dan Corey (1951)[8] | Watson dan Crick (1953)[9] | Max F. Perutz (1960)[10][11] |
Penentuan struktur kimia[sunting | sunting sumber]
Dalam menentukan struktur senyawa kimia, yang umumnya bertujuan untuk mendapatkan, minimal, pola dan multiplisitas ikatan antara semua atom dalam molekul; Bila mungkin, seseorang dapat mencari koordinat spasial tiga dimensi dari atom-atom di dalam molekul (atau zat padat lainnya). Metode yang dengannya seseorang dapat menjelaskan struktur dari sebuah molekul termasuk spektroskopi seperti resonansi magnetik nuklir (proton dan karbon-13 NMR),[12] berbagai metode spektrometri massa (untuk memberikan massa molekul keseluruhan, serta fragmen massa),[13][14] dan kristalografi sinar-x bila memungkinkan.[15][16] Teknik terakhir bisa menghasilkan model tiga dimensi dengan resolusi resolusi resolusi optik, selama kristal tersedia. Ketika sebuah molekul memiliki spin elektron yang tidak berpasangan dalam gugus fungsional strukturnya, ENDOR dan spektroskopi resonansi spin elektron juga dapat dilakukan.[17]
Teknik spektroskopi vibrasi, inframerah dan Raman, memberikan informasi pendukung penting mengenai jumlah dan kedekatan dari beberapa ikatan, dan mengenai jenis gugus fungsional (yang ikatan internalnya memberikan tanda vibrasi);[18] studi inferensial lebih lanjut yang memberi wawasan tentang struktur elektronik molekul yang berkontribusi termasuk voltametri siklik dan spektroskopi fotoelektron sinar-X. Teknik yang terakhir ini menjadi lebih penting lagi bila molekul mengandung atom logam, dan bila kristal yang dibutuhkan kristalografi atau jenis atom spesifik yang dibutuhkan oleh NMR tidak tersedia untuk dieksploitasi dalam penentuan struktur. Akhirnya, metode yang lebih khusus seperti mikroskop elektron juga berlaku dalam beberapa kasus.
Lihat pula[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ a b Chang, Raymond (2005). Kimia Dasar: Konsep-Konsep Inti Edisi Ketiga Jilid 1 (edisi ke-3rd). Jakarta: Erlangga. ISBN 979-781-039-9.
- ^ Palenik, G. J.; Jensen, W. P.; Suh, I. H. (2003). "The History of Molecular Structure Determination Viewed through the Nobel Prizes". J. Chem. Educ. 80 (7): 753. doi:10.1021/ed080p753.
- ^ James, P.; Quadroni, M.; Carafoli, E.; Gonnet, J. (1993). "Protein identification by mass profile fingerprinting". Biochem. Biophys. Res. Commun. 195: 58–64. doi:10.1006/bbrc.1993.2009.
- ^ Maxam, A. M.; Gilbert, W. (1977). "A new method for sequencing DNA". Proc. Natl. Acad. Sci. USA. 74: 560–64. doi:10.1073/pnas.74.2.560.
- ^ Hart, H.; Leslie, E. C.; David, J. H. (2003). Suminar Setiati Achmadi, ed. Organic Chemistry: A Short Course [Kimia Organik: Suatu Kuliah Singkat] (edisi ke-11th). Jakarta: Erlangga. ISBN 979-741-013-7.
- ^ Kekulé, August (1872). "Ueber einige Condensationsproducte des Aldehyds". Liebigs Ann. Chem. 162 (1): 77–124. doi:10.1002/jlac.18721620110.
- ^ Rocke, A. J. (1985). "Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory". Annals of Science. 42 (4): 355–81. doi:10.1080/00033798500200411.
- ^ Pauling L, Corey RB, Branson HR (1951). "The structure of proteins: two hydrogen-bonded helical configurations of the polypeptide chain" (PDF). Proceedings of the National Academy of Sciences of the United States of America. 37 (5): 235–40. Bibcode:1951PNAS...37..235P. doi:10.1073/pnas.37.5.235. PMC 1063348
 . PMID 14834145.
. PMID 14834145.
- ^ Watson JD, Crick FH (April 1953). "Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid" (PDF). Nature. 171 (4356): 737–8. Bibcode:1953Natur.171..737W. doi:10.1038/171737a0. PMID 13054692.
- ^ Perutz, M.F.; Rossmann, M.G.; Cullis, A.F.; Muirhead, H.; Will, G.; North, A.C.T. (1960). "Structure of haemoglobin: a three-dimensional Fourier synthesis at 5.5-A. resolution, obtained by X-ray analysis". Nature. 185 (4711): 416–22. Bibcode:1960Natur.185..416P. doi:10.1038/185416a0. PMID 18990801.
- ^ Perutz MF (1960). "Structure of haemoglobin". Brookhaven symposia in biology. 13: 165–83. PMID 13734651.
- ^ MacCallum, J. L.; et al. "Automatic Protein Structure Determination from Sparse NMR Spectroscopy Data". Biophys. J. 110 (3): 153a. doi:10.1016/j.bpj.2015.11.861.
- ^ Biemann, Klauss (2015). "Structure Determination of Natural Products by Mass Spectrometry". Annu. Rev. An. Chem. 8: 1–19. doi:10.1146/annurev-anchem-071114-040110.
- ^ Aebersold, R.; Mann, M. (2003). "Mass spectrometry-based proteomics". Nature. 422: 198–207. doi:10.1038/nature01511.
- ^ Pavia, D. L.; Lampman, G. M.; Kriz, G. S. (2001). Introduction to Spectroscopy a Guide for Students of Organic Chemistry (edisi ke-3rd). Philadelphia: Harcourt College Publishers. ISBN 978-003-058-427-5. OCLC 43859394.
- ^ Supratman, U. (2008). Elusidasi Struktur Senyawa Organik. Bandung: Widya Padjadjaran. ISBN 978-602-832-350-5.
- ^ Ho, P. J.; Starodub, D.; Saldin, D. K.; Shneerson, V. L.; Ourmazd, A.; Santra, R. (2009). "Molecular structure determination from x-ray scattering patterns of laser-aligned symmetric-top molecules". J. Chem. Phys. 131 (13). doi:10.1063/1.3245404.
- ^ Pavia, D. L.; Lampman, G. M.; Kriz, G. S.; Vyvyan, J. R. (2015). Introduction to Spectroscopy. Belmont: Cengage Learning. ISBN 978-128-546-012-3. OCLC 936352046.
Bacaan lebih lanjut[sunting | sunting sumber]
- Warren Gallagher, 2006, "Lecture 7: Structure Determination by X-ray Crystallography," dalam Chem 406: Biophysical Chemistry, self-published course notes, Eau Claire, WI, USA:University of Wisconsin-Eau Claire, Department of Chemistry, lihat [1], diakses tanggal 2 Juli 2014.
